巢晖教授课题组:诱导肿瘤细胞凋亡-铁死亡的铱(III)纳米双光子光敏剂 发表于Angew. Chem. Int. Ed.
光动力疗法(Photodynamic Therapy, PDT)是近年来兴起的一种治疗恶性肿瘤新模式,利用光敏剂在特定波长的光激活下,将细胞和组织中的分子氧转化为高细胞毒性的活性氧物种(ROS),诱导肿瘤细胞坏死及凋亡。它具有特异性高、可控、无创伤、对健康组织的副作用小等优点,近年来在肿瘤治疗中引起了广泛关注。
光敏剂是光动力疗的核心,但目前临床应用的光敏剂仍存在很多不足,如种类单一、缺乏肿瘤靶向性、稳定性较差、缺乏良好的水溶性、单光子激发、分子氧依赖等。谷胱甘肽(GSH)是细胞内主要的抗氧化物质,肿瘤微环境高浓度的GSH(浓度范围在1到15 mM之间)会消耗光敏剂在光活化下产生的ROS,从而降低光动力治疗效果,极大地限制了光敏剂在癌症治疗中的应用。因此,如何针对肿瘤微环境设计高效的光敏剂仍然是光动力治疗中需迫切解决的关键科学问题。
永利集团3044noc登录入口巢晖教授课题组长期致力于金属光敏剂研究,利用金属配合物的长激发态寿命,构筑了系列单/双光子光敏剂,用于细胞器靶向的抗肿瘤治疗(Chem. Soc. Rev., 2021, 50, 4185; Coord. Chem. Rev., 2021, 432, 213714; Nat. Chem., 2019, 11, 1041; Nat. Commun., 2020, 11, 3262; J. Am. Chem. Soc., 2022, 144, 4091; Angew. Chem. Int. Ed., 2015, 54, 14049; Angew. Chem. Int. Ed., 2017, 56, 14898; Angew. Chem. Int. Ed., 2019, 58, 14334; Angew. Chem. Int. Ed., 2020, 59, 3315; Angew. Chem. Int. Ed., 2020, 59, 20697; Angew. Chem. Int. Ed., 2021, 60, 4657; PNAS, 2018, 115, 5664; PNAS, 2019, 116, 20296)。近期,他们提出了一种新的光敏剂设计策略:通过二硫键(SS)构建铱(III)纳米双光子光敏剂(图1)。不仅可以有效地提高光敏剂的细胞摄取,还可以消耗细胞内GSH,增强肿瘤细胞对氧化应激的敏感程度,诱导细胞凋亡和铁死亡的双重死亡途径,实现对肿瘤的有效抑制。同时,借助小分子配合物和纳米聚合物之间荧光寿命差异,实现光敏剂的PLIM成像示踪和靶向PDT导航。
该研究通过将带有巯基的铱(III)配合物(Ir-SH)进行氧化聚合,成功制备了IrS NPs。利用DSPE-PEG-Biotin作进一步的表面修饰得到IrS NPs@Biotin,实现了纳米光敏剂对肿瘤细胞的靶向富集。IrS NPs@Biotin被摄取进入肿瘤细胞后,随着高浓度的GSH作用,IrS NPs@Biotin中的S-S键断裂并发生降解,有效地耗竭了内源性的GSH,并进一步导致GSH代谢水平的紊乱,使得肿瘤细胞更容易受到氧化应激的影响。降解后的铱(III)配合物选择性地富集在线粒体中,在双光子激光的照射下产生ROS(单线态氧和超氧阴离子),引起线粒体损伤和脂质过氧化物的产生,有效地诱导肿瘤细胞凋亡和铁死亡。动物实验证实,将IrS NPs@Biotin经尾静脉注射入小鼠体内后,纳米药物可选择性地在肿瘤部位富集,具有良好的肿瘤靶向性,并且有效地提升了双光子光动力治疗的效果。这项研究提出的金属纳米光敏剂构建策略和抗肿瘤作用机制,将具有非常重要的临床应用意义,为今后开发新的抗肿瘤光敏剂开辟了新的途径。
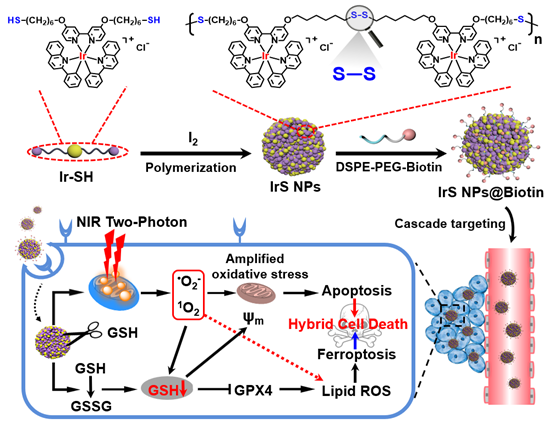
图1. 铱(III)配位聚合光敏剂诱导肿瘤细胞凋亡和铁死亡的作用机理示意图
相关研究成果近期发表在化学综合期刊Angew. Chem. Int. Ed.上。 论文第一作者为永利集团3044noc登录入口柯理兵博士和博士研究生韦方棉,论文通讯作者为永利集团3044noc登录入口巢晖教授 (Libing Ke#, Fangmian Wei#, Lina Xie, Johannes Karges, Yu Chen, Liangnian Ji, Hui Chao*, A Biodegradable Iridium(III) Coordination Polymer for Enhanced Two-Photon Photodynamic Therapy using an Apoptosis-Ferroptosis Hybrid Pathway, Angew. Chem. Int. Ed., 2022, 61, e202205429. 全文链接: https://onlinelibrary.wiley.com/doi/abs/10.1002/anie.202205429)。该工作得到国家自然科学基金、湖南省科技创新计划、生物无机与合成化学教育部重点实验室和广东省消化系统恶性肿瘤防治研究重点实验室的大力支持。

